Fázový diagram
V predchádzajúcich
statiach sme sa oboznámili s krivkou topenia, sublimačnou krivkou
a krivkou nasýtenej pary. Všetky tri krivky pre danú látku možno znázorniť
do tej istej súradnicovej sústavy s osami T a p. Vznikne graf, ktorý sa volá fázový diagram (obr. a).
Každý bod roviny fázového diagramu znázorňuje istý stav látky pri zvolenej
termodynamickej teplote T a tlaku p.
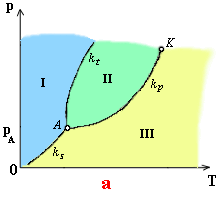
Ako vidieť z obr. a, tvorí fázový diagram krivka topenia kt ,krivka
nasýtenej pary kp a sublimačná krivka ks.
Všetky tri krivky sa stýkajú v jednom bode A,
ktorý sa nazýva trojný bod. Znázorňuje
rovnovážny stav pevnej, kvapalnej a plynnej fázy tej istej látky. Teplota
trojného bodu vody (TA=273,16 K) je základnou teplotou
termodynamickej teplotnej stupnice.
Každý
bod krivky topenia znázorňuje rovnovážny stav pevnej a kvapalnej fázy; bod
krivky nasýtenej pary znázorňuje rozličné stavy rovnovážnej sústavy kvapalina
a nasýtená para, vrátane kritického stavu látky a body sublimačnej krivky určujú
rovnovážny stav pevnej látky a jej nasýtenej pary.
Krivky kt , kp , ks
rozdeľujú rovinu fázového diagramu na tri oblasti I, II, III. Keď je bod
určujúci stav látky v oblasti I, látka je v pevnom skupenstve; body
v oblasti II znázorňujú rozličné stavy kvapaliny. Body, ktoré patria do
oblasti III, t.j. body ležiace pod krivkou nasýtenej pary a sublimácie,
zodpovedajú plynnému skupenstvu látky, ktoré má nižší tlak ako nasýtená para
s rovnakou teplotou. Toto plynné skupenstvo sa nazýva prehriata para.
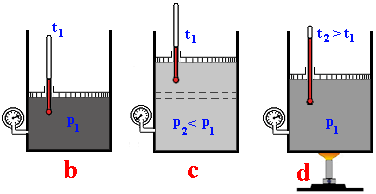
Ako utvoriť prehriatu paru ? Dá sa uvažovať o valci
s piestom, pod ktorým je nasýtená para bez prítomnosti kvapaliny (obr. b). Keď piest izotermicky zdvihneme (obr. c), zväčší sa objem pary, čím sa zníži jej tlak. Keďže sa
objem pary zvýšil bez prítomnosti kvapaliny zmenšila sa aj hustota pary.
Vznikla para, ktorá nie je nasýtená, ale prehriata. Prehriata para je taká, ktorá má menší tlak a hustotu
ako nasýtená para s rovnakou teplotou. Prehriatu
paru môžeme získať aj tak, že nasýtenú paru zohrievame bez prítomnosti
kvapaliny (obr.
d).
Prechod z jednej oblasti do druhej vo fázovom
diagrame predstavuje vždy dej pri ktorom nastáva zmena skupenstva. Rozoberieme
dej na obr. e znázornený úsečkou S1
S3 .prechod z bodu S1 do bodu S2
znázorňuje zvýšenie teploty pevnej látky pri stálom tlaku p1. V stave
určenom bodom S2 sa pevná látka topí a postupne sa celá
premení na kvapalinu. Teplota T2 je teplotou topenia pri
tlaku p1 úsečka S2 S3 znázorňuje
izobarický dej s kvapalinou, pri ktorom sa zvyšuje teplota kvapaliny.
Kvapalina prejde do stavu určeného bodom S3 .
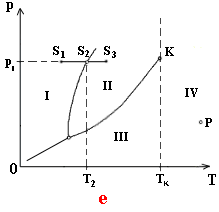
Bod P na obr. e patrí do oblasti IV, ktorá znázorňuje stavy pevného
skupenstva látky pri teplote vyššej, ako je kritická teplota. Toto plynné
skupenstvo nazývame plyn. Keď má biť plyn
skvapalnený schladíme ho pred kompresiou pod kritickú teplotu. Látky, ktoré
majú vysokú kritickú teplotu možno ochladiť adiabatickým ochladením plynu.
Prudkým vyparovaním niektorých skvapalnených plynov možno dosiahnuť veľmi nízke
teploty, pri ktorých kvapalnie ďalší plyn. Týmito dvoma spôsobmi sa podarilo už
po roku 1830 skvapalniť všetky vtedy známe plyny okrem kyslíka, dusíka, vodíka
a hélia. V roku 1877 bol skvapalnený kyslík a dusík, v roku
1898 vodík a nakoniec v roku 1908 hélium. Nové metódy skvapalňovania
plynov (najmä kyslíka, vodíka a hélia) vypracoval neskôr sovietsky fyzik
Piotr Leonidovič Kapica (nar. r. 1894).