Krivka nasýtenej pary
Pri
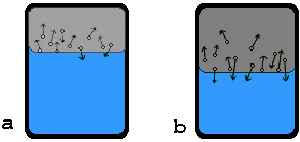
vyparovaní kvapaliny v uzavretej nádobe je na začiatku tohoto deja počet
molekúl, ktoré opúšťajú povrch kvapaliny väčší, ako počet molekúl, ktoré sa za
rovnaký čas vracajú späť do kvapaliny (obr. a).
Preto sa objem kvapaliny zmenšuje a súčasne sa zväčšuje hustota
a tlak pary nad kvapalinou. Po istom čase vznikne stav, keď počet molekúl,
ktoré sa do kvapaliny za istý čas vracajú, rovná sa počtu molekúl, ktoré povrch
kvapaliny za rovnaký čas opúšťajú (obr. b).
Objemy kvapaliny a pary sa nemenia, zostáva konštantný aj tlak pary
a teplota sústavy kvapalina + para. Sústava je v rovnovážnom stave,
ktorý sa niekedy volá dynamická rovnováha.
Para,
ktorá je v rovnovážnom stave so svojou kvapalinou, nazýva sa nasýtená para. Z predchádzajúceho tvrdenia
vyplýva, že v uzavretej nádobe za prítomnosti kvapaliny je nasýtená para.
Z pokusov
vyplýva, že tlak nasýtenej pary nezávisí pri stálej
teplote od objemu pary. Ak objem priestoru nad kvapalinou izotermicky
zväčšíme, tlak nasýtenej pary dosiahne pôvodnú hodnotu. Keďže tlak nasýtenej
pary nezávisí od objemu, neplatí pre ňu Boylov – Mariottov zákon, príp. stavová
rovnica ideálneho plynu. Tým sa nasýtená para podstatne odlišuje od ideálneho
plynu.
Keď
zvýšime teplotu sústavy kvapalina + jej nasýtená para, má kvapalina väčšiu
vnútornú energiu, väčšia časť z nej sa vyparí, čím sa zväčší hustota
molekúl nasýtenej pary (obr.). Z meraní vyplýva, že tlak nasýtenej pary
nad kvapalinou so zvyšovaním teploty stúpa.
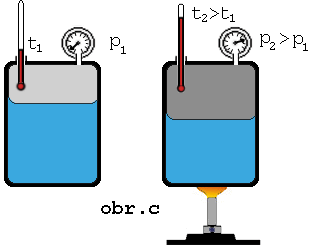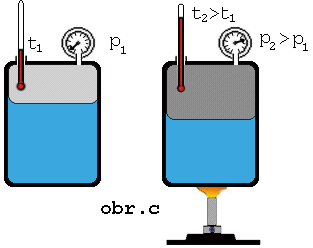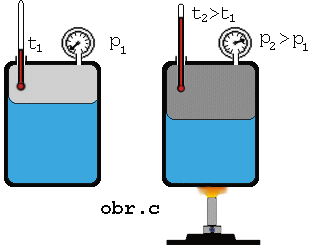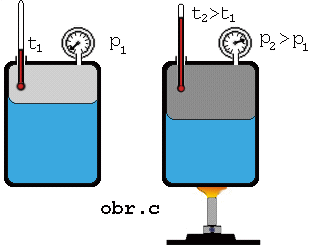
Keď na
základe merania tlaku pary pri rozličných rozličných teplotách (obr. c) zostrojíme graf závislosti tlaku nasýtenej pary
od teploty, dostaneme krivku nasýtenej pary (obr.
d). Táto závislosť nie je lineárna
a pre rôzne látky je rozličná.
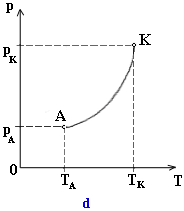
Každý
bod krivky nasýtenej pary zodpovedá jednému stavu nasýtenej pary a súčasne
kvapaliny, ktorá je s ňou v rovnovážnom stave (dynamickej rovnováhe).
Tento stav je určený teplotou T a tlakom p. Množina týchto
bodov krivky nasýtenej pary znázorňuje teda všetky stavy rovnovážnej sústavy
kvapalina + nasýtená para.
Začiatočnému
bodu A krivky (obr. d) prislúcha najmenšia hodnota teploty TA
a tlaku pA, pri ktorých existuje kvapalina
a nasýtená para v rovnovážnom stave. Teplota TA je
teplotou tuhnutia kvapalnej fázy pri tlaku pA (bodom A sa začína krivka topenia a končí sa
sublimačná).
Pri
zvyšovaní teploty rovnovážnej sústavy
kvapalina + nasýtená para stúpa hustota nasýtenej pary, hustota
kvapaliny naopak klesá. Rozhranie medzi kvapalinou a jej nasýtenou parou
je však stále ostré a zreteľné. Pri teplote TK, kritickej
teplote, sa hustota kvapaliny rovná hustote pary. Medzi kvapalinou
a jej nasýtenou parou zmizne rozhranie a látka sa stane rovnorodou.
Pri teplote vyššej ako TK už neexistuje látka
v kvapalnej fáze. Preto sa krivka nasýtenej pary končí v bode K (obr. d).
Koncový
bod krivky nasýtenej pary sa volá kritický bod a znázorňuje
kritický stav látky. Kritický stav je určený kritickou teplotou
TK kritickým tlakom pK a hustotou
Q . Veličiny TK , pK , ρK , sú
pre každú látku charakterizujúcimi konštantami.
Z krivky nasýtenej pary
príslušnej látky možno získať ešte jednu dôležitú informáciu a to teplotu
varu kvapaliny pri danom vonkajšom tlaku nad kvapalinou. Prečo je to tak, sa dá
vysvetliť rozborom varu z hľadiska molekulovej fyziky.
Pri vare sa vnútri kvapaliny tvoria
bubliny nasýtenej pary, ktoré zväčšujú svoj objem a vystupujú na voľný
povrch kvapaliny. Tento dej nastáva práve vtedy, keď tlak nasýtenej pary bublín
sa rovná približne vonkajšiemu tlaku. Keď sa zväčší tlak nad voľným povrchom
kvapaliny, var nastane až po takom zvýšení teploty kvapaliny, že sa tlak vnútri
bublín vyrovná vonkajšiemu tlaku. Teplota varu sa teda zvyšuje so zvyšovaním
vonkajšieho tlaku. Túto teplotu pre daný vonkajší tlak po zistíme
z krivky nasýtenej pary tak, že k tlaku nasýtenej pary ps
≐ po
vyhľadáme príslušnú teplotu.