Z hľadiska molekulovej
fyziky sa vyparovanie vysvetľuje takto:
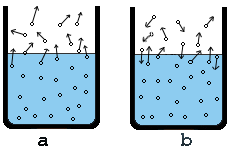
Molekuly kvapaliny konajú tepelný pohyb. Keď niektoré
molekuly majú na voľnom povrchu kvapaliny takú energiu, že sú schopné prekonať
sily, ktoré ich pútajú k ostatným molekulám, potom tieto molekuly uniknú
do priestoru nad kvapalinou a utvoria paru (obr. a).
Para je plynné skupenstvo látky. Ak je voľný povrch kvapaliny v styku so
vzduchom, vzniknutá para difunduje do okolitého vzduchu.
Niektoré
molekuly pary v dôsledku neusporiadaného pohybu sa vracajú znova do
kvapaliny (obr. b). Pri vyparovaní kvapaliny
v otvorenej nádobe je počet týchto molekúl vždy menší ako počet molekúl,
ktoré v rovnakom čase z kvapaliny unikajú.
Keďže
pri vyparovaní kvapalinu opúšťajú najrýchlejšie molekuly, zmenšuje sa stredná
kynetická energia molekúl kvapaliny, čo má za následok zníženie teploty
vyparujúcej sa kvapaliny. Teplota vzniknutej pary sa však rovná teplote
kvapaliny, lebo molekuly pri opustení kvapaliny vplyvom príťažlivých síl
strácajú svoju prebytočnú kinetickú energiu. Majú však väčšiu potenciálnu
energiu. Preto vnútorná energia pary s danou hmotnosťou je väčšia ako
vnútorná energia kvapaliny s rovnakou hmotnosťou a teplotou.
![]()
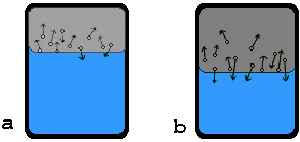
Pri vyparovaní kvapaliny v uzavretej nádobe je na
začiatku tohoto deja počet molekúl, ktoré opúšťajú povrch kvapaliny väčší, ako
počet molekúl, ktoré sa za rovnaký čas vracajú späť do kvapaliny (obr. a). Preto sa objem kvapaliny zmenšuje
a súčasne sa zväčšuje hustota a tlak pary nad kvapalinou. Po istom
čase vznikne stav, keď počet molekúl, ktoré sa do kvapaliny za istý čas
vracajú, rovná sa počtu molekúl, ktoré povrch kvapaliny za rovnaký čas opúšťajú
(obr. b). Objemy kvapaliny a pary sa
nemenia, zostáva konštantný aj tlak pary a teplota sústavy kvapalina +
para. Sústava je v rovnovážnom stave, ktorý sa niekedy volá dynamická rovnováha.
Para,
ktorá je v rovnovážnom stave so svojou kvapalinou, nazýva sa nasýtená para. Z predchádzajúceho tvrdenia
vyplýva, že v uzavretej nádobe za prítomnosti kvapaliny je nasýtená para.
Z pokusov
vyplýva, že tlak nasýtenej pary nezávisí pri stálej
teplote od objemu pary. Ak objem priestoru nad kvapalinou izotermicky
zväčšíme, tlak nasýtenej pary dosiahne pôvodnú hodnotu. Keďže tlak nasýtenej
pary nezávisí od objemu, neplatí pre ňu Boylov – Mariottov zákon, príp. stavová
rovnica ideálneho plynu. Tým sa nasýtená para podstatne odlišuje od ideálneho
plynu.
Keď zvýšime
teplotu sústavy kvapalina + jej nasýtená para, má kvapalina väčšiu vnútornú
energiu, väčšia časť z nej sa vyparí, čím sa zväčší hustota molekúl
nasýtenej pary (obr.). Z meraní vyplýva, že tlak nasýtenej pary nad kvapalinou so zvyšovaním
teploty stúpa.
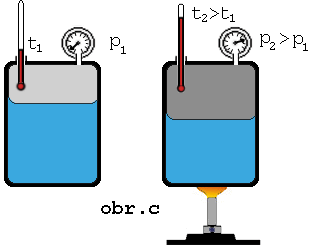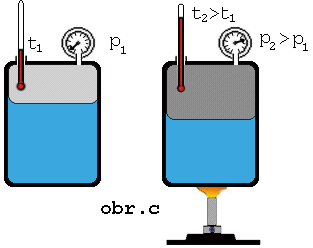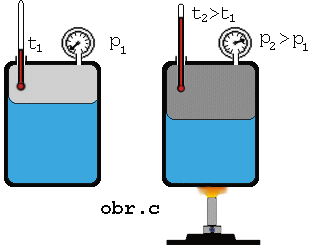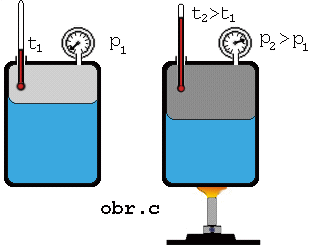
Keď na
základe merania tlaku pary pri rozličných rozličných teplotách (obr. c) zostrojíme graf závislosti tlaku nasýtenej pary
od teploty, dostaneme krivku
nasýtenej pary .Táto závislosť nie je lineárna a pre rôzne
látky je rozličná.